قانون اول ترمودینامیک
قبل از ورود به قانون اول ترمودینامیک، باید رابطه بین گرما و کار و مفهوم انرژی درونی را درک کنیم. درست مانند جرم، انرژی همیشه حفظ می شود، یعنی نه می توان آن را ایجاد کرد و نه از بین برد، بلکه می تواند از شکلی به شکل دیگر تبدیل شود. انرژی داخلی یک ویژگی ترمودینامیکی سیستم است که به انرژی مرتبط با مولکولهای سیستم اشاره دارد که شامل انرژی جنبشی و انرژی پتانسیل است.
هرگاه سیستمی در اثر برهمکنش گرما، کار و انرژی درونی دچار تغییری شود، انتقال و تبدیل های انرژی متعددی به دنبال دارد. با این حال، در طول این انتقال، هیچ تغییر خالص در انرژی کل وجود ندارد.
به طور مشابه، اگر به قانون اول ترمودینامیک نگاه کنیم ، تأیید می کند که گرما نوعی انرژی است. معنی آن این است که فرآیندهای ترمودینامیکی با اصل بقای انرژی اداره می شوند. قانون اول ترمودینامیک گاهی اوقات به عنوان قانون بقای انرژی نیز شناخته می شود.
قانون اول ترمودینامیک چیست؟
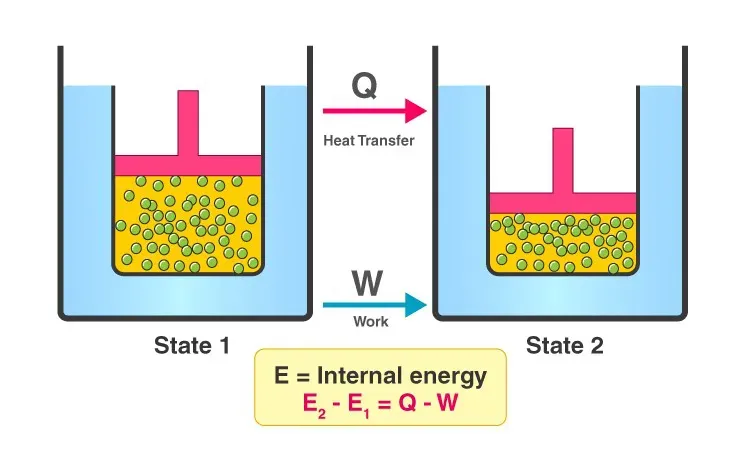
یک سیستم ترمودینامیکی در حالت تعادل دارای یک متغیر حالت است که به عنوان انرژی داخلی (E) شناخته می شود. بین دو سیستم، تغییر انرژی داخلی برابر است با تفاوت انتقال حرارت به سیستم و کار انجام شده توسط سیستم.
قانون اول ترمودینامیک می گوید که انرژی جهان ثابت باقی می ماند. اگرچه ممکن است بین سیستم و محیط رد و بدل شود، نمی توان آن را ایجاد یا از بین برد. قانون اساساً به تغییرات حالت های انرژی در اثر کار و انتقال حرارت مربوط می شود. مفهوم بقای انرژی را دوباره تعریف می کند.
قانون اول ترمودینامیک
قانون اول ترمودینامیک بیان می کند که گرما شکلی از انرژی است و بنابراین فرآیندهای ترمودینامیکی تابع اصل بقای انرژی هستند. این بدان معنی است که انرژی گرمایی ایجاد یا از بین نمی رود. با این حال، می تواند از یک مکان به مکان دیگر منتقل شود و به اشکال دیگر انرژی تبدیل شود.
برای کمک به درک مفهوم قانون اول، میتوانیم مثال رایج یک موتور حرارتی را در نظر بگیریم . در یک موتور حرارتی، انرژی حرارتی به انرژی مکانیکی تبدیل میشود و این فرآیند نیز برعکس است. موتورهای حرارتی بیشتر به عنوان سیستم های باز طبقه بندی می شوند. اصل کار یک موتور حرارتی این است که از روابط مختلف بین گرما، فشار و حجم سیال کاری که معمولاً گاز است استفاده می کند. گاهی اوقات تغییرات فاز نیز ممکن است رخ دهد که شامل گاز به مایع و برگشت به گاز می شود.
قانون اول معادله ترمودینامیک
معادله قانون اول ترمودینامیک به صورت داده شده است
ΔU = q + W
جایی که،
ΔU = تغییر در انرژی داخلی سیستم
q = مجموع جبری انتقال حرارت بین سیستم و محیط اطراف
W = تعامل کاری سیستم با محیط اطرافش
نکاتی که باید به خاطر بسپارید
برای یک سیستم ایزوله، انرژی (E) همیشه ثابت می ماند.
انرژی داخلی تابع نقطه ای و ویژگی سیستم است. انرژی داخلی یک ویژگی گسترده (وابسته به جرم) است، در حالی که انرژی ویژه یک ویژگی فشرده (مستقل از جرم) است.
برای یک گاز ایده آل، انرژی داخلی تنها تابعی از دما است.
چند مثال:
س: یک گاز در یک سیستم فشار ثابتی دارد. 45 ژول گرما در محیط اطراف سیستم از دست می رود. 450 ژول کار روی سیستم انجام می شود. انرژی داخلی سیستم را پیدا کنید.
راه حل:
ΔU = q+w
ΔU = 45J + 450J
ΔU = 495J
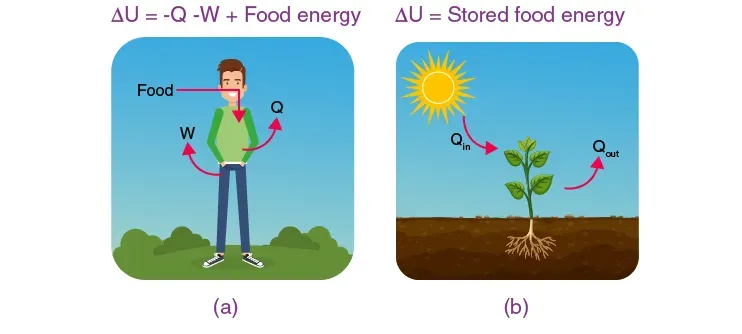
به طور کلی، اگر بخواهیم انرژی داخلی را که با ΔU نشان داده می شود، پیدا کنیم، مهم است که رابطه بین محیط و سیستم را در نظر بگیریم. ما قبلاً طبق قانون می دانیم که انرژی نه ایجاد می شود و نه از بین می رود. بنابراین، می توانیم بگوییم که هر چیزی که توسط محیط از دست می رود، توسط سیستم به دست می آید. علاوه بر این، منطقه اطراف گرما را از دست می دهد و برخی کارها را روی سیستم انجام می دهد. بنابراین اگر به q و w نگاه کنیم، آنها در معادله مثبت هستند و این عمدتا به دلیل گرما گرفتن سیستم و انجام کار روی خود است.
قانون اول محدودیت های ترمودینامیک
در اینجا به محدودیت های قانون اول ترمودینامیک می پردازیم. این قانون بیان می کند که هرگاه یک سیستم تحت هر فرآیند ترمودینامیکی قرار گیرد، همیشه تعادل انرژی خاصی را حفظ می کند. با این حال، قانون اول امکان پذیر بودن فرآیند یا تغییر حالتی را که سیستم تحت آن قرار می گیرد، ارائه نمی دهد.
همچنین بخوانید: قانون دوم ترمودینامیک
به عنوان مثال، قانون اول نمی تواند توضیح دهد که چرا وقتی یک میله فلزی در یک سر گرم می شود و در طرف دیگر گرم نمی شود، گرما از انتهای گرم به انتهای سرد جریان می یابد و بالعکس. قانون اول فقط انتقال انرژی را که در طول این فرآیند انجام می شود کمیت می کند. این قانون دوم ترمودینامیک است که معیاری را برای امکان سنجی فرآیندهای مختلف ارائه می دهد. ما یک مثال می زنیم و مفهوم را بیشتر درک می کنیم.
ماشین حرکت دائمی از نوع اول (PMM1)
ساختن ماشینی که بتواند به طور مداوم کار مکانیکی را بدون مصرف انرژی به طور همزمان تامین کند، غیرممکن است. چنین ماشین فرضی به عنوان ماشین حرکت دائمی از نوع اول شناخته می شود. این نوع ماشین ها قانون اول ترمودینامیک را نقض می کنند و در واقعیت وجود ندارند.
قانون اول ترمودینامیک برای یک سیستم بسته
کار انجام شده برای یک سیستم بسته حاصل ضرب فشار اعمال شده و تغییر حجمی است که در اثر فشار اعمال شده رخ می دهد.
w = - P ΔV
جایی که P فشار خارجی ثابت بر روی سیستم است و ΔV تغییر در حجم سیستم است. این به طور خاص کار "فشار-حجم" نامیده می شود.
انرژی داخلی یک سیستم بسته به تعامل کاری که در سراسر مرزهای آن اتفاق می افتد، افزایش یا کاهش می یابد. اگر کار روی سیستم انجام شود انرژی داخلی افزایش می یابد و اگر کار توسط سیستم انجام شود کاهش می یابد. هر گونه فعل و انفعال گرمایی که در سیستم با محیط اطرافش اتفاق می افتد، انرژی داخلی آن را نیز تغییر می دهد. اما از آنجایی که انرژی ثابت می ماند (از قانون اول ترمودینامیک)، کل تغییر انرژی درونی همیشه صفر است. اگر انرژی توسط سیستم از بین برود، آنگاه توسط محیط اطراف جذب می شود. اگر انرژی در یک سیستم جذب شود، به این معنی است که انرژی توسط محیط اطراف آزاد شده است.
ΔUsystem = -ΔUsuroundings
که در آن سیستم ΔU تغییر در کل انرژی داخلی سیستم است و ΔU محیط اطراف تغییر در انرژی کل محیط اطراف است.